
You are now leaving Neuraxpharm UK’s website.
This link will take you to a non-Neuraxpharm UK website. Neuraxpharm UK does not recommend, endorse or accept liability for sites controlled by third-parties.

This link will take you to a non-Neuraxpharm UK website. Neuraxpharm UK does not recommend, endorse or accept liability for sites controlled by third-parties.


95%
aller für 1 Stunde geplanten Infusionen wurden innerhalb ca. 1 Stunde ohne Unterbrechung abgeschlossen.*2
*± 5 Minuten (Daten aus den ULTIMATE I und II Studien)
Ein Schulungsvideo zur BRIUMVI®-Infusion wird in Kürze verfügbar sein.

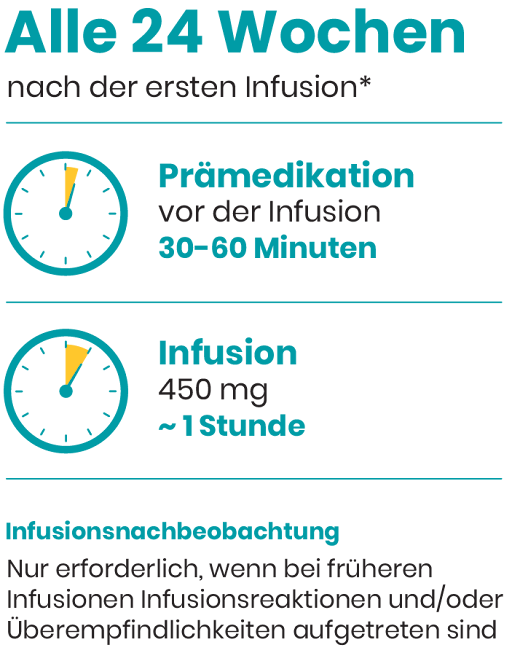
30 bis 60 Minuten vor jeder Infusion
müssen Sie die beiden folgenden
Medikamente verabreichen (oral,
intravenös, intramuskulär oder subkutan),
um die Häufigkeit und Schwere von
infusionsbedingten Reaktionen zu
reduzieren:
• 100 mg Methylprednisolon oder 10–20
mg Dexamethason (oder ein
Äquivalent)
• Antihistaminikum (z. B. Diphenhydramin)
Zusätzlich kann auch eine
Vorbehandlung mit einem Mittel gegen
Fieber (z. B. Paracetamol) in Betracht
gezogen werden.

• Infusion an Tag°1: 150°mg über ca. 4° Stundenb
• Infusion an Tag°15: 450°mg über ca. 1° Stundeb
• Nachfolgende Infusionen (alle 24 Wochen, erstmals 24 Wochen nach der 1. Infusion): 450°mg über ca. 1° Stundeb
• Patient:innen, die mit BRIUMVI® behandelt werden, sollten während der Infusionen beobachtet werden.

1-stündige Infusionsnachbeobachtung an Tag 1 und Tag 15 erforderlich.
Bei nachfolgenden Infusionen ist keine Überwachung nach der Infusion erforderlich, es sei denn, es wurden infusionsbedingte Reaktionen und/oder eine Überempfindlichkeit beobachtet.
Ärzte/Ärztinnen sollten die Patienten darüber informieren, dass infusionsbedingte Reaktionen bis zu 24 Stunden nach der Infusion auftreten können.
Hinweise zur Dosierung bei Patient:innen mit IRR-Symptomen sind Abschnitt 4.2 der Zusammenfassung der Merkmale des Arzneimittels zu entnehmen.1
• Ein HBV-Screening ist bei allen Patientinnen und Patienten vor Beginn der
Behandlung gemäß den örtlichen Leitlinien durchzuführen.
• Patientinnen und Patienten mit aktiver HBV-Infektion (d. h. einer aktiven
Infektion, bestätigt durch positiven HBsAg- und Anti-HB-Test) dürfen nicht mit
Ublituximab behandelt werden.
• Patientinnen und Patienten mit positiver Serologie (d. h. HBsAg-negativ und
HB-Kernantikörper-positiv (HBcAb+)) oder HBV-Träger
(Oberflächenantigen-positiv, HBsAg+) sollen vor Behandlungsbeginn
Spezialisten für Lebererkrankungen konsultieren und gemäß den örtlichen
medizinischen Standards überwacht und behandelt werden, um eine
Hepatitis-B-Reaktivierung zu verhindern.
Es ist nicht bekannt, ob Ublituximab in die Muttermilch übergeht. Es ist bekannt, dass menschliches IgG in den ersten Tagen nach der Geburt in die Muttermilch ausgeschieden wird, wobei die Konzentration kurz danach auf niedrige Werte sinkt; daher kann ein Risiko für den gestillten Säugling während dieses kurzen Zeitraums nicht ausgeschlossen werden. Danach könnte Ublituximab während der Stillzeit angewendet werden, sofern klinisch erforderlich.

• Patient:innen, die mit Ublituximab behandelt werden, sollten während der Infusionen auf alle Symptome einer infusionsbedingten Reaktion hin beobachtet werden.
• Sie sollten zudem nach Abschluss der ersten beiden Infusionen für eine Dauer von mindestens einer Stunde auf alle Symptome einer infusionsbedingten Reaktion hin beobachtet werden.
• Ab der dritten Infusion ist eine Überwachung nach der Infusion nur dann erforderlich, wenn bei den vorherigen Infusionen Infusionsreaktionen und/oder Überempfindlichkeit beobachtet wurden.»

Wenn eine Infusion versäumt wurde, muss sie so bald als möglich nachgeholt werden. Warten Sie nicht bis zum nächsten geplanten Termin! Zwischen den Folgeinfusionen sollte das Behandlungsintervall von 24 Wochen (mindestens 5 Monate) eingehalten werden.
BRIUMVI® ist eine klare bis opaleszente, farblose bis gelbliche Lösung.
Die Lösung nicht verwenden, wenn sie verfärbt ist oder Fremdpartikel enthält.»
Aus mikrobiologischen Gründen sollte die zubereitete Infusionslösung sofort verwendet werden. Wenn sie nicht sofort verwendet wird, liegen die Lagerungszeiten und -bedingungen vor der Verwendung in der Verantwortung des Anwenders und sollten normalerweise nicht länger als 24 Stunden bei 2–8 °C und anschließend 8 Stunden bei Raumtemperatur betragen, es sei denn, die Verdünnung erfolgte unter kontrollierten und validierten aseptischen Bedingungen. Falls eine intravenöse Infusion nicht am selben Tag vollständig verabreicht werden kann, ist die restliche Lösung zu entsorgen.
Referenzen
1BRIUMVI®. Fachinformation. Neuraxpharm, 04/2025
2Fox EJ, Steinman L, Hartung H-P, et al. Infusionsbedingte Reaktionen (IRRs) mit Ublituximab bei Patienten mit schubförmiger Multipler Sklerose (RMS): Post-hoc-Analysen aus den Phase-3-Studien ULTIMATE I und II. Präsentiert im Rahmen der Jahrestagung der American Academy of Neurology (AAN) 2022; 2.–7. und 24.–26. April 2022; Seattle, WA (USA).
Dieser Abschnitt enthält Informationen über ein Produkt von Neuraxpharm. Durch den Zugriff auf diese Website bestätigen Sie, dass Sie ein Angehöriger der Gesundheitsberufe in Deutschland sind.