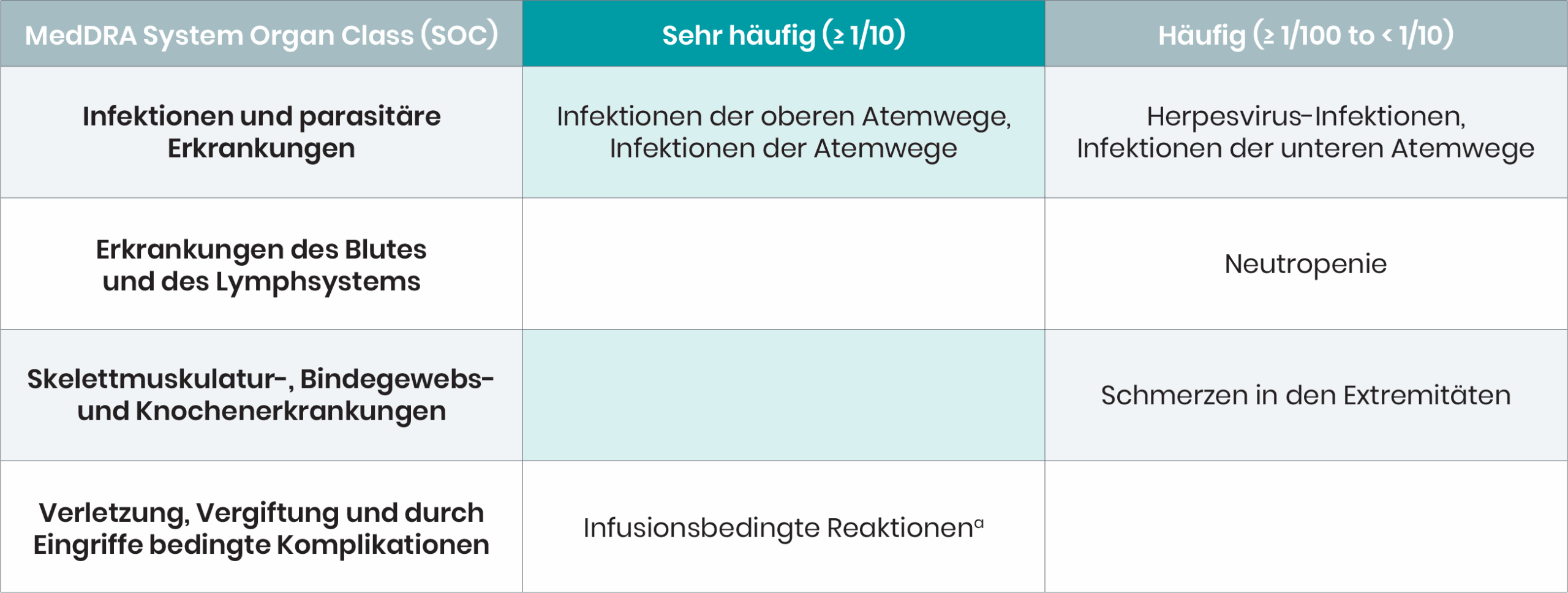
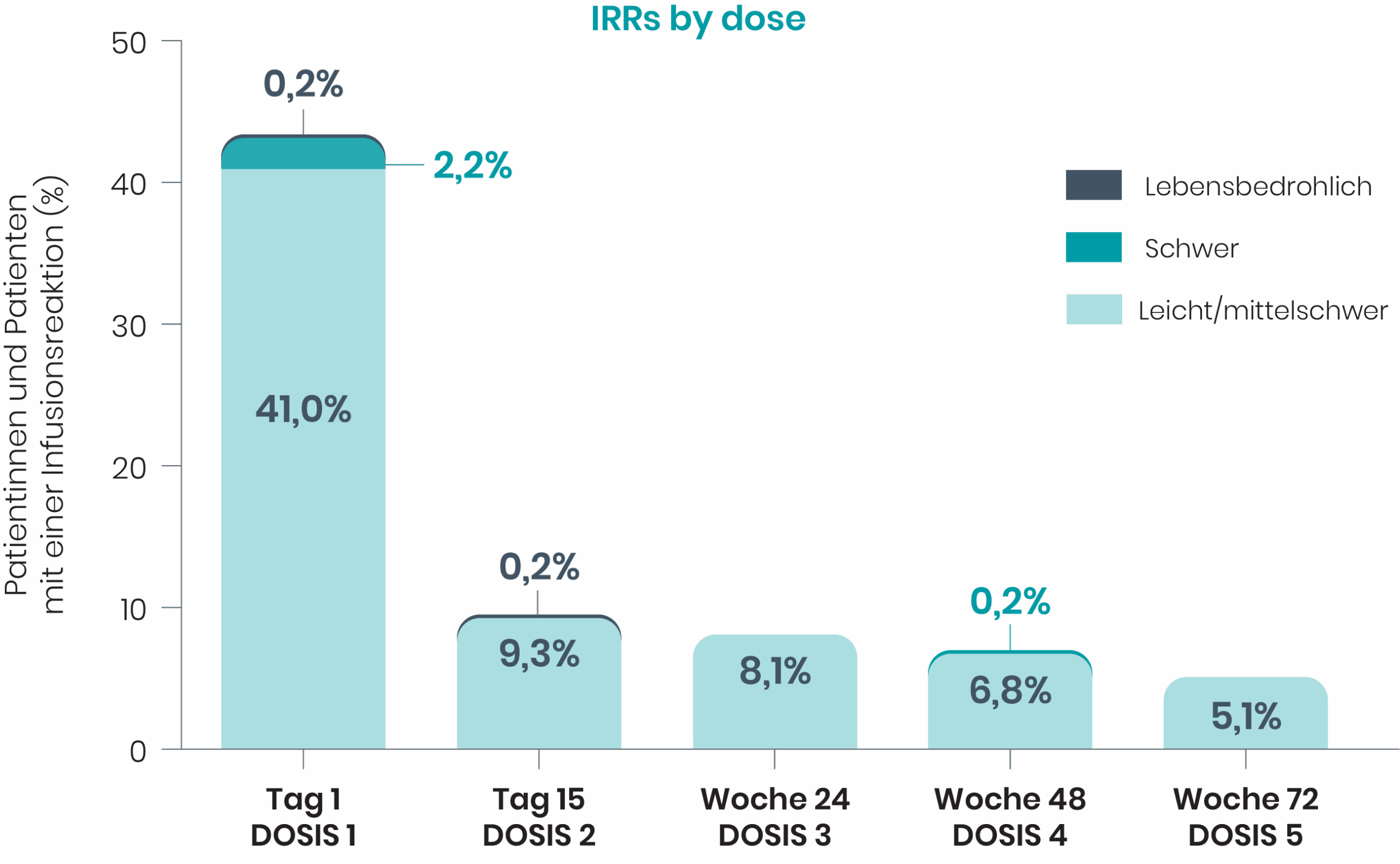
BRIUMVI® 150 mg Konzentrat zur Herstellung einer Infusionslösung. ▼
BRIUMVI® wird angewendet für die Behandlung von erwachsenen Patientinnen und Patienten mit schubförmiger Multipler Sklerose (RMS) mit aktiver Erkrankung, definiert durch klinischen Befund oder Bildgebung.
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen siehe Abschnitt 4.8 der Fachinformation.