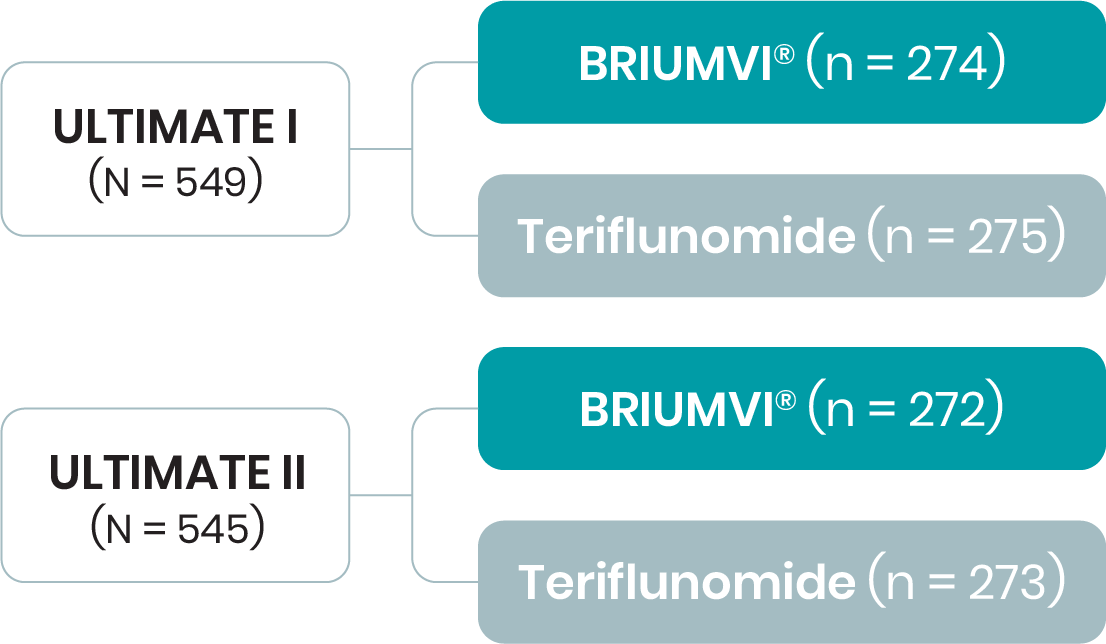
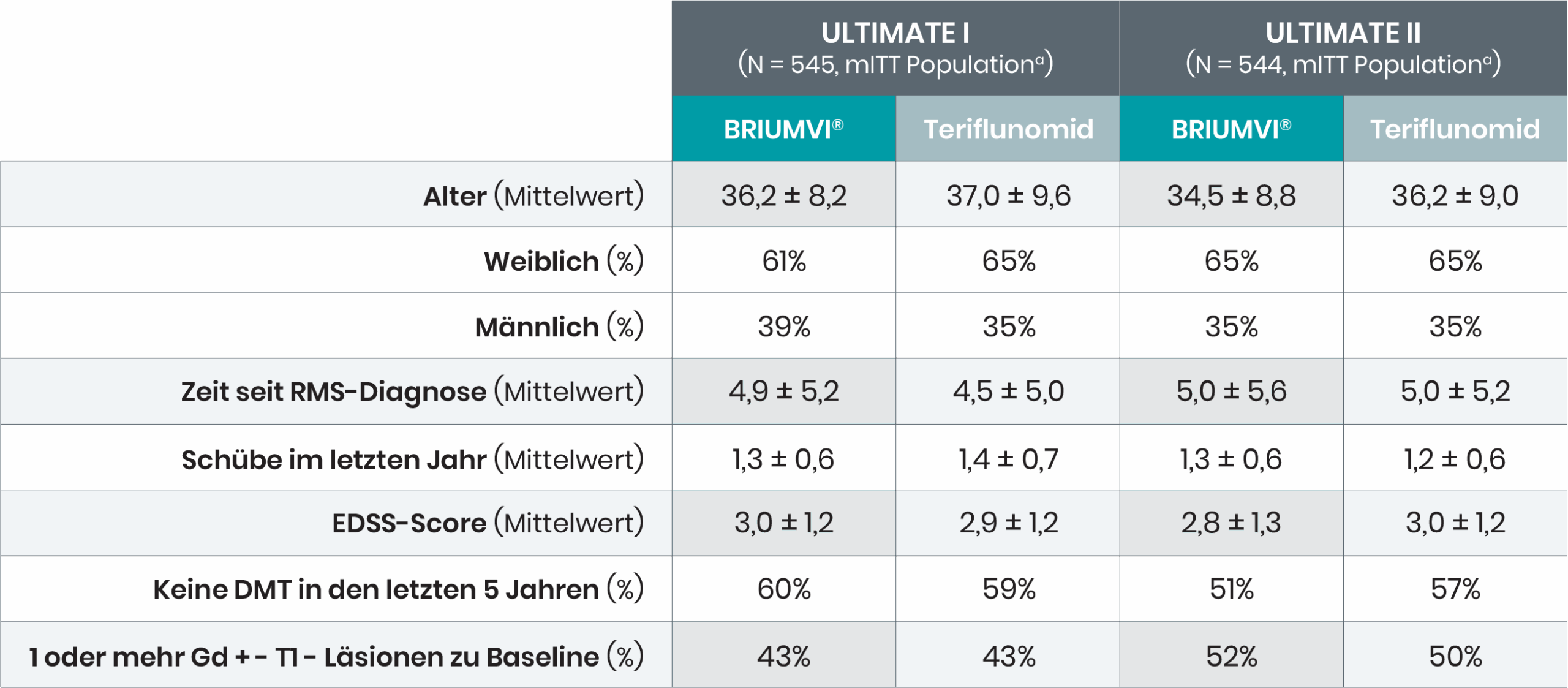
Einschlusskriterien:
- Schubförmige Multiple Sklerose
- Expanded Disability Status Scale (EDSS)-Score von 0–5,5
- Zwei oder mehr Schübe in den letzten 2 Jahren vor dem Screening oder
- Ein Schub und/oder mindestens 1 Gadolinium-anreichernde (Gd+-) T1-Läsion im Jahr vor dem Screening»
Neurologische Beurteilungen wurden alle 12 Wochen durchgeführt, und die Patientinnen und Patienten wurden in den Wochen 12, 24, 48 und 96 einer MRT-Untersuchung unterzogen