
You are now leaving Neuraxpharm UK’s website.
This link will take you to a non-Neuraxpharm UK website. Neuraxpharm UK does not recommend, endorse or accept liability for sites controlled by third-parties.

This link will take you to a non-Neuraxpharm UK website. Neuraxpharm UK does not recommend, endorse or accept liability for sites controlled by third-parties.
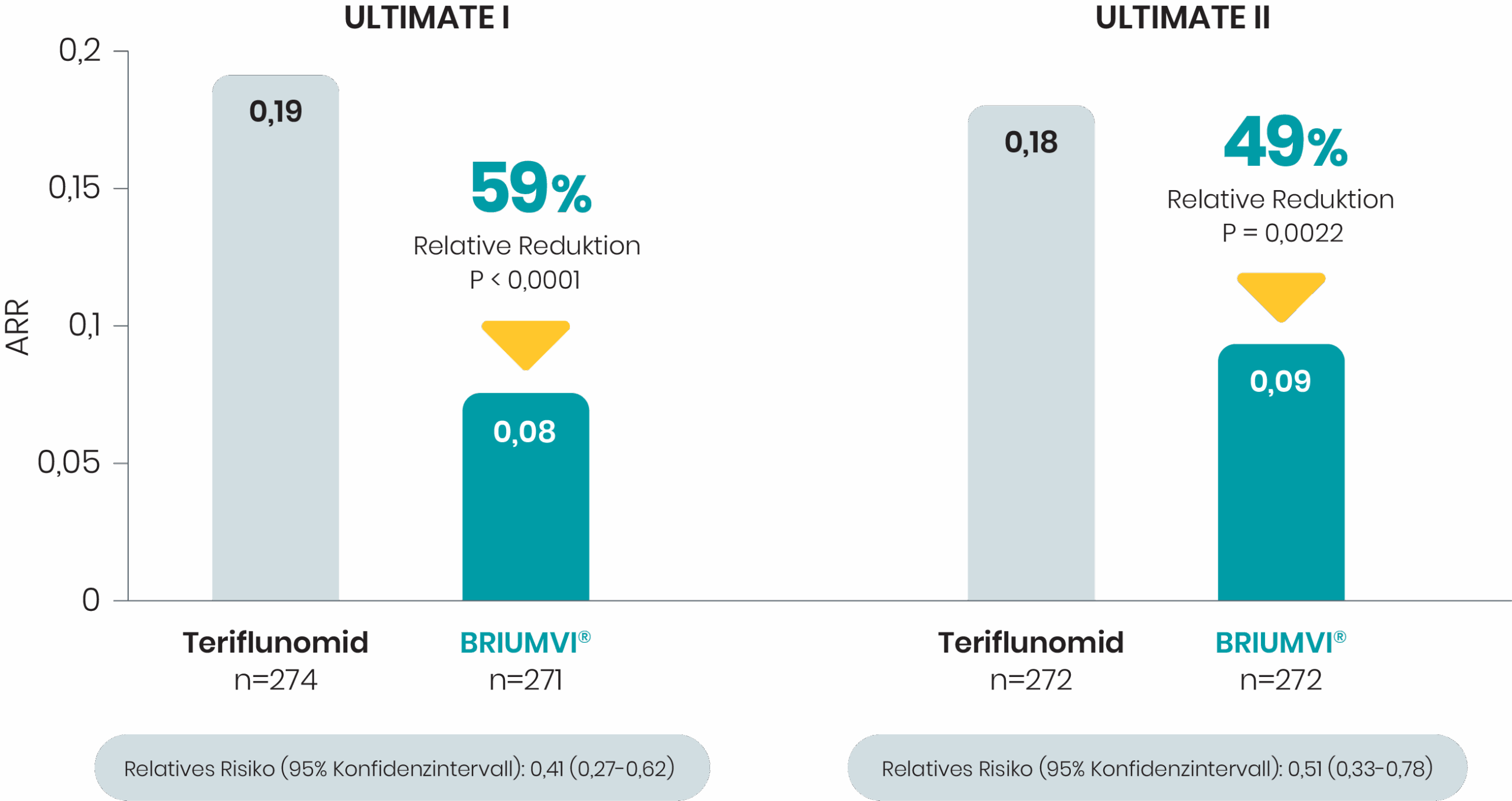
Signifikante Verringerung der Schübe (primärer Endpunkt)
Erster Anti-CD20-Antikörper, der in zwei klinischen Phase-III-Studien eine ARR von <0,1 erreichtea,1-6
In den klinischen Studien ULTIMATE I und II reduzierte BRIUMVI® die Schubraten im Vergleich zu Teriflunomid nach 96 Wochen signifikant1,2
Primärer Endpunkt: Annualisierte Schubrate (ARR)


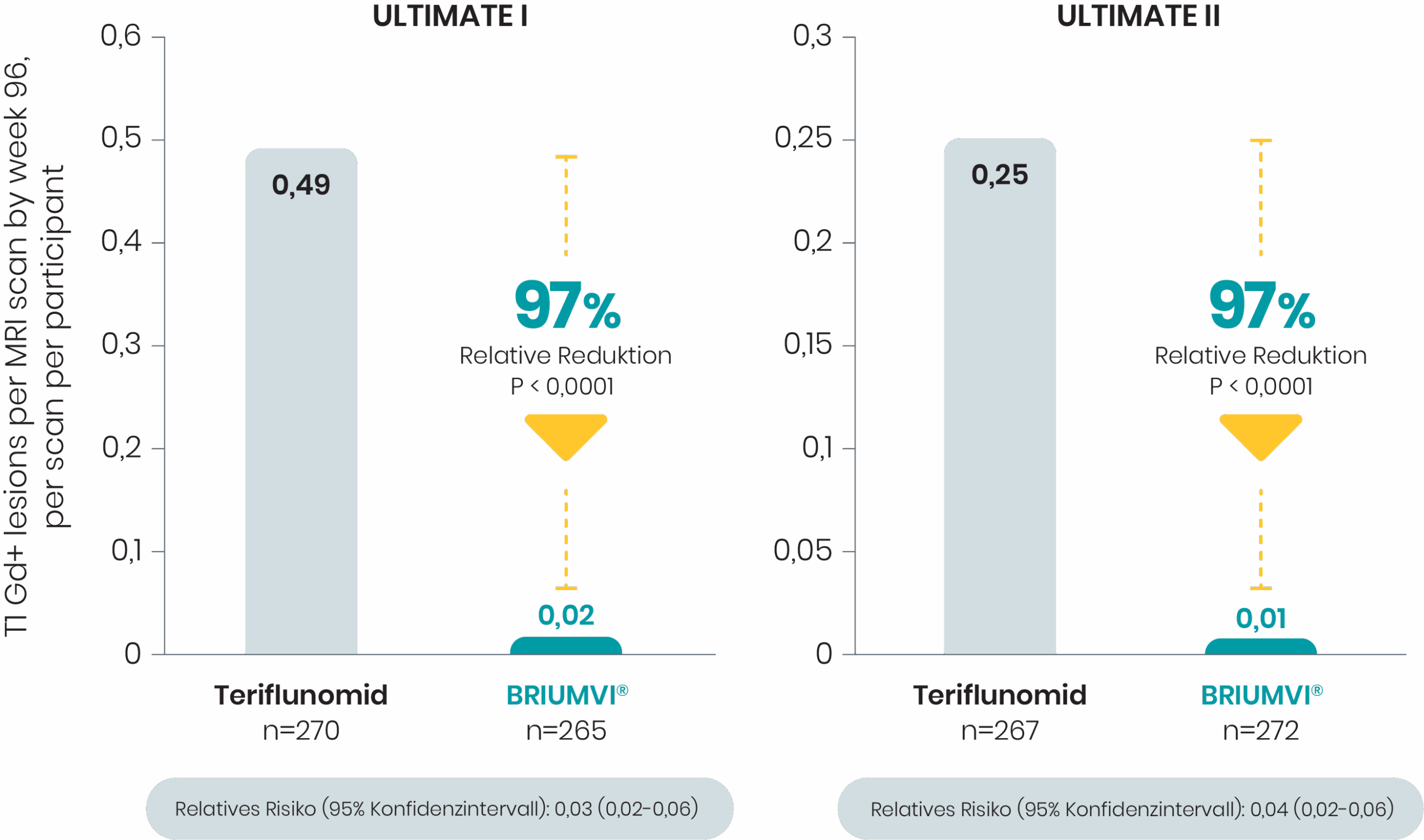
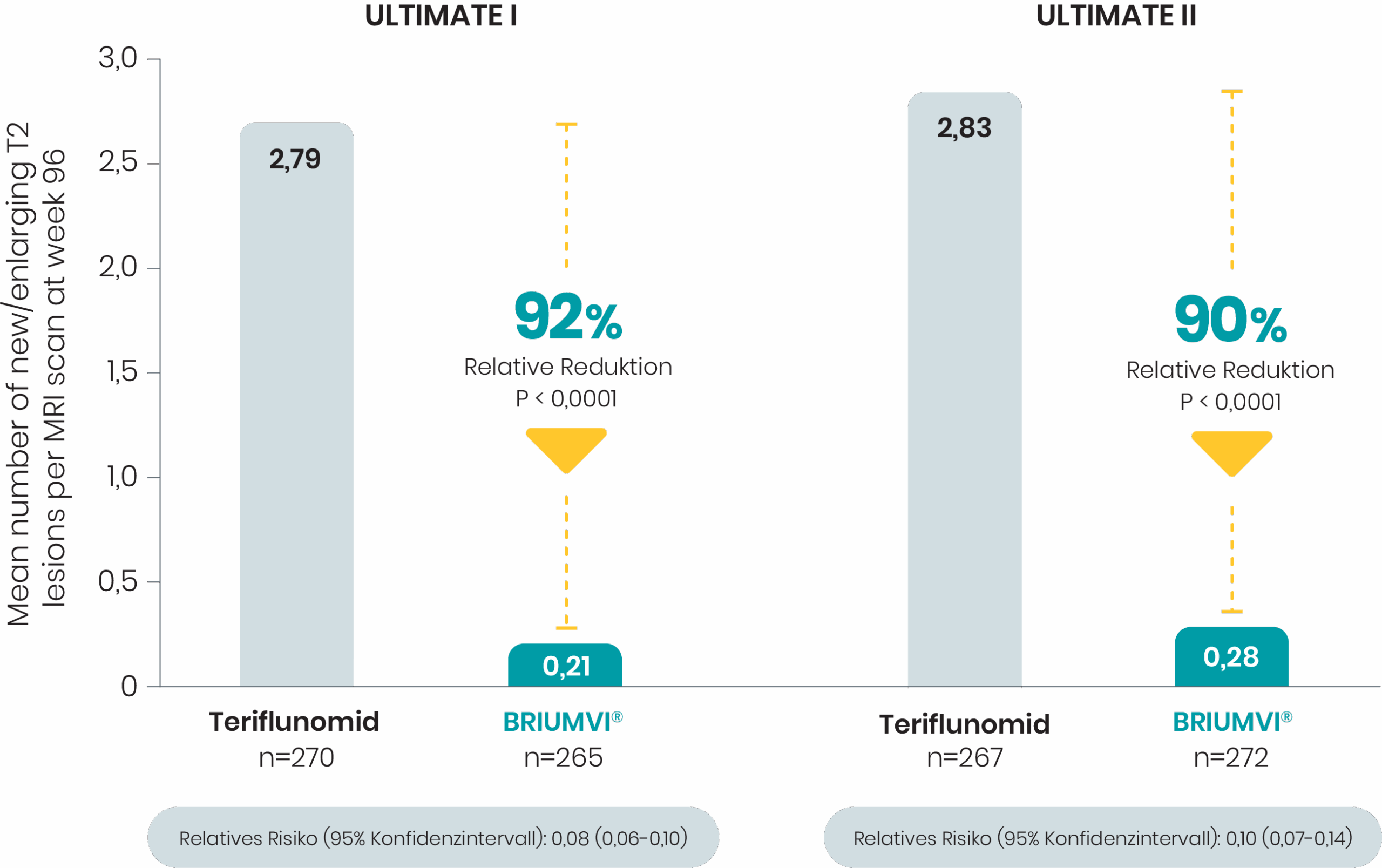
Nahezu vollständige Suppression der Läsionen
BRIUMVI® zeigte eine nahezu vollständige Suppression der Läsionen im Vergleich zu Teriflunomid1,2
Based on Kaplan-Meier estimates and mITT population.
Behinderungsprogression und -verbesserung
In den Studien ULTIMATE I und II wurde die bestätigte Progression der Behinderung (CDP) bei Patientinnen und Patienten nach 12 sowie nach 24 Wochen untersucht1,2
Zum Ende der doppelblinden Studienphase von ULTIMATE I und II wurden bei ≥ 95% der Patientinnen und Patienten keine bestätigte Behinderungsprogression festgestellt.1,2
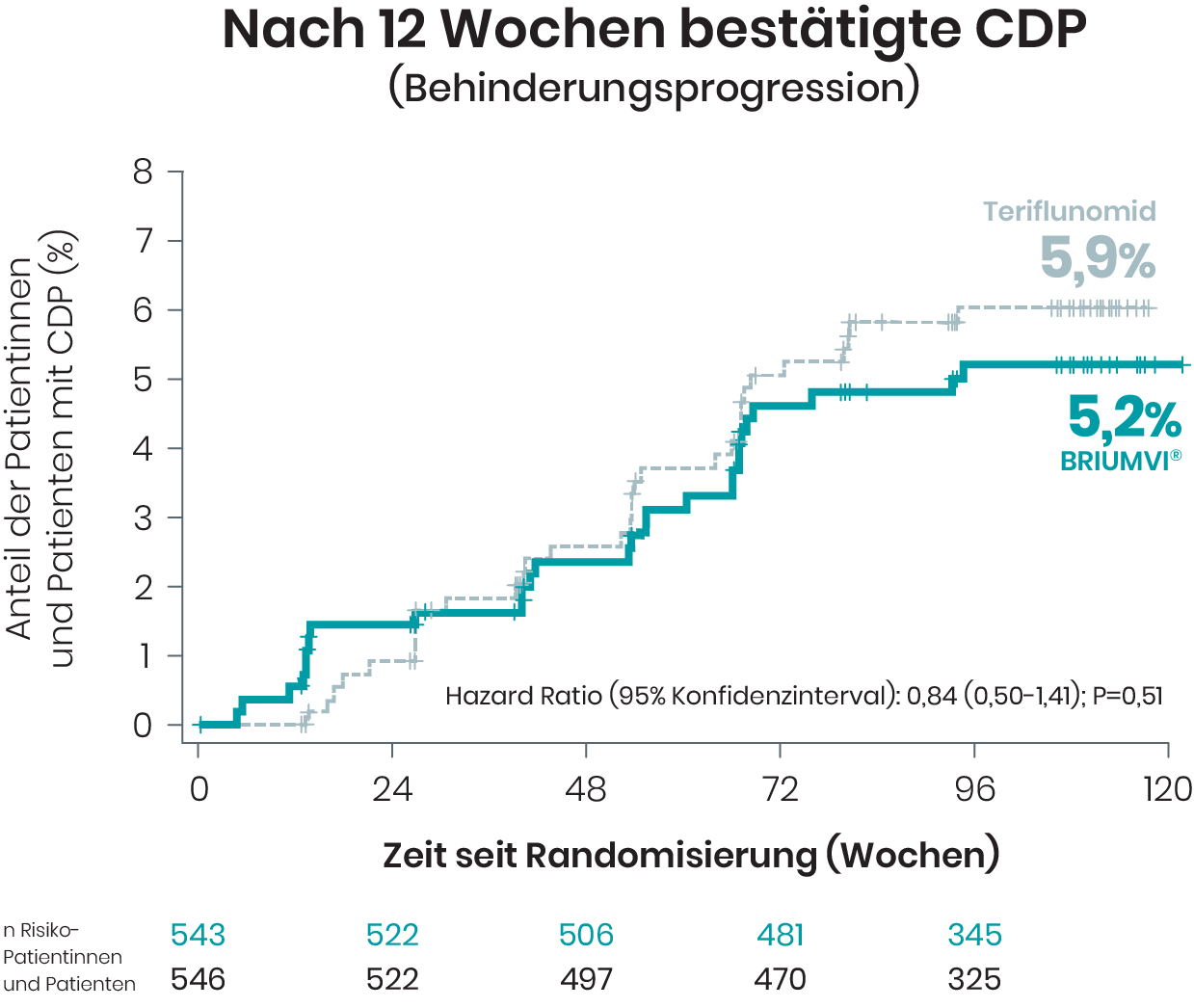
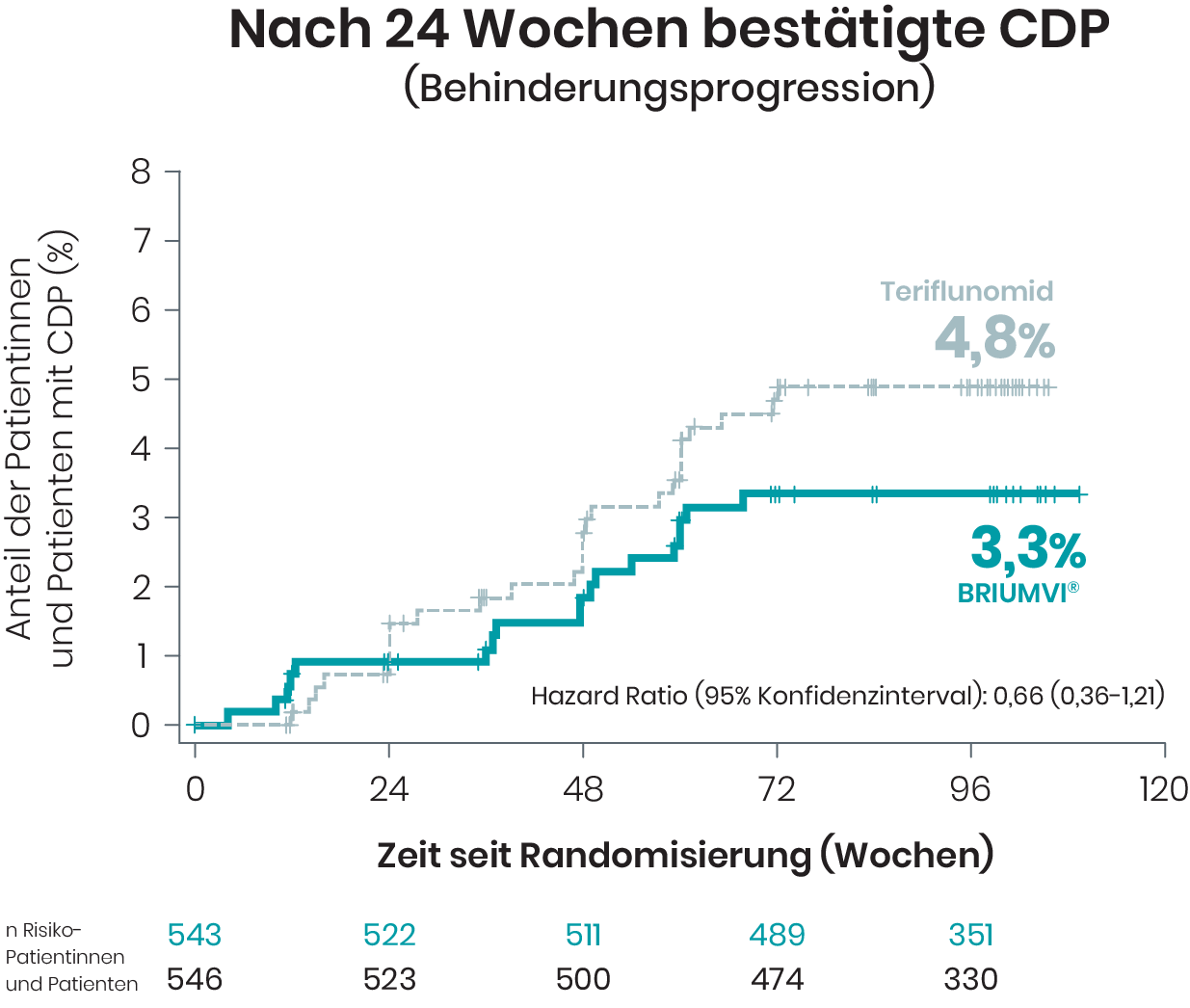
Basierend auf Kaplan-Meier-Schätzern und mITT-Population.
In den Studien ULTIMATE I und II wurde die bestätigte Verbesserung der Behinderung (CDI) bei Patientinnen und Patienten nach 12 sowie nach 24 Wochen untersucht2
Von den Patientinnen und Patienten, die BRIUMVI® erhielten, erreichten 12 % nach 12 Wochen und 9,6 % in one line nach 24 Wochen eine CDI zum Ende der doppelblinden Studienphase
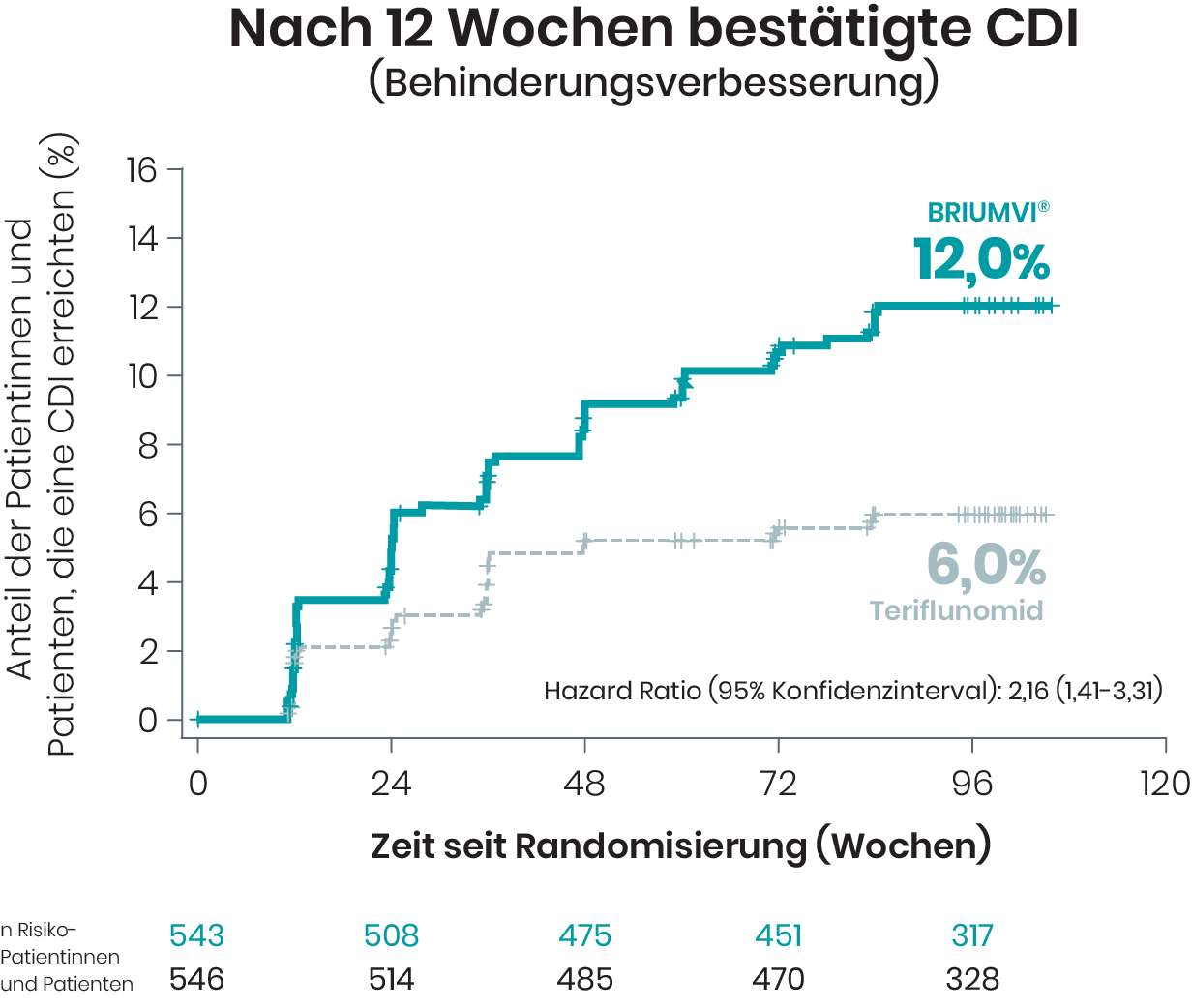
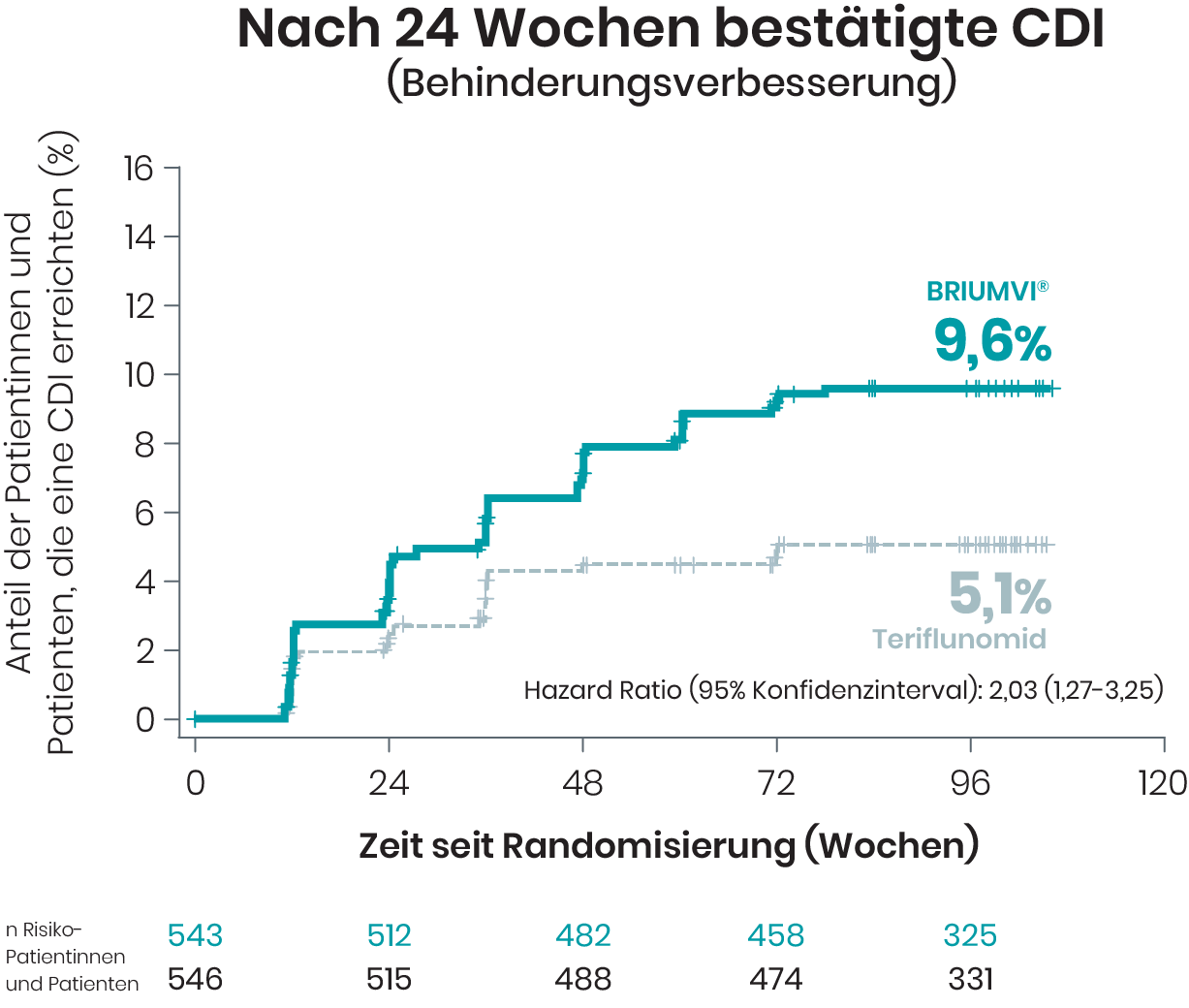
Basierend auf Kaplan-Meier-Schätzern und mITT-Population.
Anstieg des Anteils der Patient:innen ohne Anzeichen einer Krankheitsaktivität (NEDA)
NEDA-3 (Wochen 0-96)7



Gepoolte Post-hoc-Analyse von ULTIMATE°I und ULTIMATE°II: NEDA-3-Daten mit neuer Baseline

Referenzen
BRIUMVI® wird angewendet für die Behandlung von erwachsenen Patientinnen und Patienten mit schubförmiger Multipler Sklerose (RMS) mit aktiver Erkrankung, definiert durch klinischen Befund oder Bildgebung.
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen siehe Abschnitt 4.8 der Fachinformation.
Dieser Abschnitt enthält Informationen über ein Produkt von Neuraxpharm. Durch den Zugriff auf diese Website bestätigen Sie, dass Sie ein Angehöriger der Gesundheitsberufe in Deutschland sind.